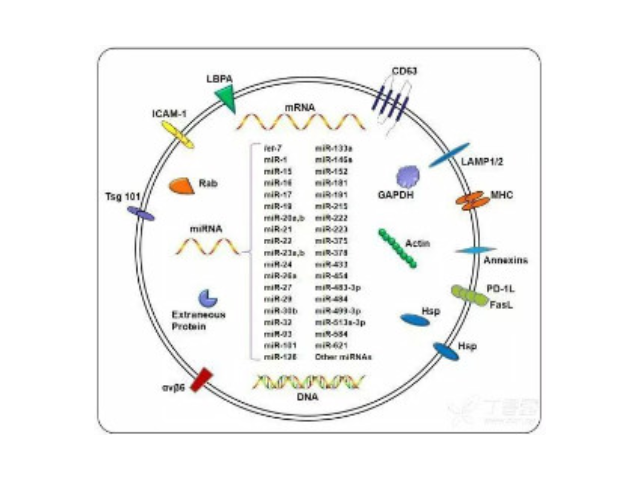
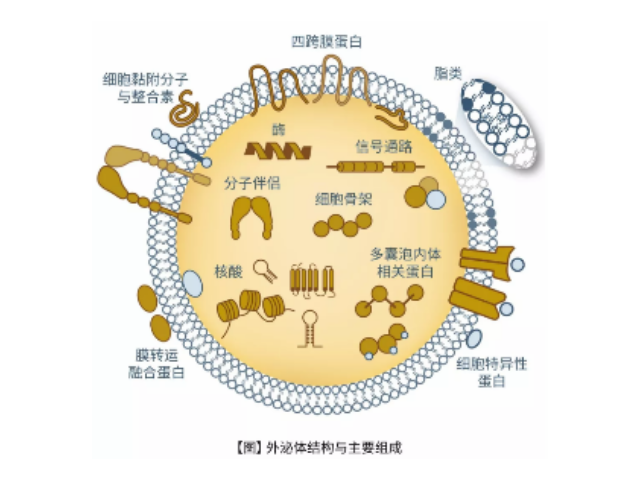
- 产地
- 苏州
- 品牌
- 细胞高效转染试剂
- 型号
- 齐全
- 是否定制
- 是
细胞转染效率低下的几个大坑:1.准备不足做脂质体转染的时候,在开展正式实验前要多做预试验,优化转染条件。优化转染条件包括:脂质体的用量、DNA密度、细胞密度、脂质体和DNA混合孵育时间等等。2.电压过大做电转的时候,如果电压太大,往往会发生细胞大量死亡的情况。不同的细胞,需要的电压是不一样的。这就要求我们多做预实验,多摸索条件。对于大多数细胞来说,其较佳电压位于250-1250v/cm。另外,就是进行转染的细胞应该处于对数生长期。处于对数生长期的细胞的抗损伤能力是较强的。细胞浓度应该处于5x106到1x107/mL之间。每次转染的质粒应该控制在4-6μg,如果﹥10μg,转染效率也较大降低。电击后,应该将DNA和细胞混合液在室温下放置10分钟,使细胞恢复损伤。由于脂质体对细胞有一定的毒性,所以转染时间一般不超过24小时。青岛细胞高效转染试剂价格

细胞转染操作方法:转染,是将外源性基因导入细胞内的一种专门技术。随着基因与蛋白功能研究的深入,转染目前已成为实验室工作中经常涉及的基本方法。转染大致可分为物理介导、化学介导和生物介导三类途径。电穿孔法、显微注射和基因属于通过物理方法将基因导入细胞的范例;化学介导方法很多,如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;生物介导方法,有较为原始的原生质体转染,和现在比较多见的各种细菌介导的转染技术。理想细胞转染方法,应该具有转染效率高、细胞毒性小等优点。细菌介导的转染技术,是目前转染效率较高的方法,同时具有细胞毒性很低的优势。但是,细菌转染方法的准备程序复杂,常常对细胞类型有很强的选择性,在一般实验室中很难普及。其它物理和化学介导的转染方法,则各有其特点。开封细胞高效转染试剂厂家批发价因为DNA摄入效率和表达水平在不同实验中差异较大,实验必须很小心。

细胞转染是指将外源分子如DNA,RNA等导入真核细胞的技术。随着分子生物学和细胞生物学研究的不断发展,转染技术已成为研究和控制真核细胞基因功能的常规工具。在研究基因功能、调控基因表达、突变分析和蛋白质生产等生物学试验中,其应用越来越***。那么,罗氏都有哪些转染试剂,其优势都有哪些?图1.细胞转染过程X-tremeGENE9DNA转染试剂简介:X-tremeGENE9DNA转染试剂是脂质和其它成分混合而得的一类多组份试剂,溶于80%乙醇中,经0.2μm滤膜过滤,然后封装于玻璃小瓶中,适用于细胞分析的多种实验。
细胞转染,你至少要掌握以下几点:主要有下面几种方法::化学法:磷酸钙法、DEAE-右旋糖苷法、阳离子脂质体法;物理法:电穿孔法、显微注射法、颗粒传递法;细菌介导法:逆转录细菌、腺细菌A.阳离子脂质体法:带正电的脂质体与核酸带负电的磷酸基团形成复合物被细胞内吞。特点:简单通用,适用性广,转染效率高,重复性好,但转染时需除血清,转染效率随细胞类型变化大。由于脂质体复合物与贴壁细胞的接触机会远大于悬浮细胞,所以贴壁比悬浮转染效率要高。悬浮细胞建议使用电穿孔法。B.电穿孔法:利用高压电脉冲对细胞膜的干扰,使其形成利于核酸进入的微孔转化、转染、转导几个名词是从事生命科学研究的初学者经常碰到的。

细胞转染效率影响因素:1.细胞密度一般来说,当细胞密度达到60%~80%时进行转染可以取得较高的转染效率,过低或过高都会影响转染效果。2.细胞生长状态这点非常关键,很多时候传代次数太少或者太多都将导致细胞对转染试剂敏感度的改变。因此,为了提高转染效率以及转染稳定性、降低细胞毒性,应尽量使用适度传代的细胞系,并在不同次实验时保持细胞传代次数的一致性。3.细胞种类不同细胞种类的细胞在做转染时所需要的转染体系是不同的,不能一种体系用在所有类型细胞的转染实验。有血清时的转染 血清一度曾被认为会降低转染效率。青岛细胞高效转染试剂价格
瞬时和稳定表达DNA转染后,转入基因的表达可以在1-4天内检测到。青岛细胞高效转染试剂价格
细胞转染的原理、操作步骤以及小技巧:脂质体转染操作步骤:(1)细胞培养:取6cm细胞皿,向每孔中加入2mL含1~2×105个细胞培养液,37℃CO2培养密度至40%~60%,密度过大,转染后不利筛选细胞。(2)转染液制备:在EP管中制备以下两液(为转染每一个孔细胞所用的量)A液:用不含血清培养基稀释1ug质粒DNA。B液:用不含血清培养基稀释2ul脂质体。分别将A液与B液轻弹混匀,静置5分钟。(3)吸取B液加入至A液中,轻弹混匀。室温中置10-15分钟。(4)转染准备:用1mL不含血清培养液漂洗两次,再加入4mL不含血清培养液。(5)转染:把A/B复合物缓缓加入培养液中,摇匀,37℃温箱置6~24小时,吸除无血清转染液,换入正常培养液继续培养。(6)瞬时转染后,可在48h-72h细胞长满之后,提取细胞蛋白或者RNA,验证敲减/过表达效率。青岛细胞高效转染试剂价格
细胞转染方法:1.脂质体转染法阳离子脂质体表面带正电荷,能与核酸的磷酸根通过静电作用,将DNA分子包裹入内,形成DNA脂复合物,也能被表面带负电的细胞膜吸附,再通过融合或细胞内吞进入细胞。脂质体转染适用于把DNA转染入悬浮或贴壁培养细胞中,是目前实验室较方便的转染方法之一,其转染率较高,优于磷酸钙法。由于脂质体对细胞有一定的毒性,所以转染时间一般不超过24小时。常用细胞类型:cos-7、BHK、NIH3T3、Hela等2.电穿孔转染法电流能够可逆地击穿细胞膜形成瞬时的水通路或膜上小孔促使DNA分子进入胞内,这种方法就是电穿孔。当遇到某些脂质体转染效率很低或几乎无法转入时建议用电穿孔法转染。一般...
- 重庆正规细胞高效转染试剂供应商 2024-08-15
- 贵阳正规细胞高效转染试剂单价 2024-08-15
- 合肥细胞高效转染试剂厂家推荐 2024-08-15
- 开封正规细胞高效转染试剂产品介绍 2024-08-14
- 广州正规细胞高效转染试剂进货价 2024-08-14
- 广州细胞高效转染试剂直销厂家 2024-08-14
- 重庆正规细胞高效转染试剂报价 2024-08-14
- 温州细胞高效转染试剂厂家供应 2024-08-14
- 芜湖正规细胞高效转染试剂哪家便宜 2024-08-14
- 无锡正规细胞高效转染试剂推荐厂家 2024-08-13
- 苏州细胞高效转染试剂直销价 2024-08-13
- 南京细胞高效转染试剂哪家好 2024-08-13
- 无锡长沙细胞高效转染试剂 2024-08-12
- 合肥细胞高效转染试剂哪家便宜 2024-08-12
- 杭州细胞高效转染试剂产品介绍 2024-08-12
- 唐山正规细胞高效转染试剂哪家好 2024-08-12


- 宁波原代细胞分离试剂盒销售厂家 11-10
- 贵阳原代细胞分离试剂盒 11-10
- 太原原代细胞分离试剂盒平均价格 11-10
- 南京RNA提取试剂销售厂家 11-10
- 芜湖正规原代细胞分离试剂盒直销厂家 11-10
- 杭州天津原代细胞分离试剂盒 11-10
- 正规外泌体提取试剂服务电话 11-10
- 珠海原代细胞分离试剂盒报价 11-10
- 太原RNA提取试剂价格 11-10
- 济南正规原代细胞分离试剂盒进货价 11-10