要想让激发激光进入更深的层面,大致可从两个方面入手,装置优化与标本改造。关于装置优化,我们可以把激光束变得更细,使能量更加集中,就能让激光穿透更深。关于标本,其中影响光传播的主要是物质吸收和散射,解决这个问题,我们需要对样本进行透明化处理。一种方法是运用某种物质将标本浸泡,使其中的物质(主要是脂质)被破坏或溶解。另一种方法是运用电泳将脂质电解,让标本“透明度”提高。高光子密度带来的高能量容易损伤细胞,所以双光子显微镜使用高能量锁模脉冲激光器。这种激光器发出的激光具有很高的峰值能量和很低的平均能量,其脉冲达到最大值所持续的周期只有十万亿分之一秒,而其频率可以达到80至100兆赫,这样即能达到双光子激发的高光子密度要求,又能不损伤细胞,使扫描能更好地进行。用双光子显微镜看看你的皮肤有没有重焕新生。国外2PPLUS双光子显微镜授权商
实验从理论和实验上评估了多焦点v2PE显微镜的空间分辨率,并与单光子荧光显微镜进行了对比,实验中v2PE的激发波长为521nm,使用放大倍率为100倍的物镜,尺寸为0.6AU,对直径100nm的荧光颗粒进行了测试性成像,共获得40幅不同采样深度的图像合成为三维图像。图像在横向和纵向的半高全宽分别是177nm和297nm,这些值接近显微镜的理论分辨率。后续还利用软件模拟从理论上研究了多焦点v2PE显微技术的空间分辨率,模拟计算显示v2PE点扩散函数(PSF)的横向半高宽与单光子激发荧光(1PE)相似,轴向的半高宽较1PE减少,可以提高空间分辨率。国外激光荧光双光子显微镜商家显微成像技术包含:双光子显微镜、宽场荧光显微镜、共聚焦显微镜、全内反射荧光显微镜等多种成像方式。

利用钙成像技术记录大脑活动,随着功能光学成像技术的发展,神经学家们已经可以研究脑区和神经元内部的工作情况。功能钙成像技术就是其中之一,其主要原理是将外源性荧光信号和生理现象耦合起来——通过荧光染料信号的改变反映细胞内游离钙离子浓度,以此细胞的功能状态。目前它被广泛应用于实时监测一群相关神经元内钙离子的变化,从而判断其功能活动。该技术的出现使得科学家可以亲眼目睹神经信号在神经网络之中时间和空间上的传递穿梭。
在传统宽场显微镜中,来自标本不同纵深的光线都可投射到同一焦平面(感光元件)上,所以其成像是整个样品的重叠像,没有纵向分辨能力。单光子激光共聚焦显微镜用针空有效滤除了杂散光,分辨率有了本质上的提高,拥有了对样品的特定焦平面精细成像的能力,可以进行三维成像、动态成像等。然而,针空在滤除杂散光的同时也将大部分来自焦平面的荧光滤除了,只有很弱的荧光到达检测器。若要提高信号强度,需要加大激发光功率,这又会导致对活细胞的光毒性和荧光分子的光漂白增加。双光子显微镜蕞大的优势来源于其双光子光源的非线性光学效应,与单光子共聚焦显微镜蕞大的不同在于无须使用针空限制光学散射,其具体优势如下所述。双光子显微镜能够在细胞甚至是亚细胞水平上对神经细胞的形态结构、离子浓度、细胞运动、进行直接成像监测。

后续实验使用碘化丙啶(PI)来指示细胞在7、8、9和10分钟的延时观察后的损伤情况,来验证该光学系统对活细胞长期观察的适用性。在观察期间,88个焦点以100毫秒的曝光时间,曝光间隔1s照射样品,激发强度为3.21×104W/cm2,激发波长为525nm,使用前文提到的60×物镜及1.0AU孔径,图5(a)-(d)为引入PI的成像图,(e)-(h)为相应的相应衬度图。改变激发条件为每照射500ms间隔5s,得到相应的(i)-(p)。由图像可知,延时观察小于8分钟的情况下不造成可见细胞损伤,对于实际3D延时成像,由于焦平面是移动的,所以预期细胞存活时间会更长,可见这是一种在3D在体延时成像中具有很大优势的成像方案。双光子显微镜为什么穿透能力强?国外2PPLUS双光子显微镜授权商
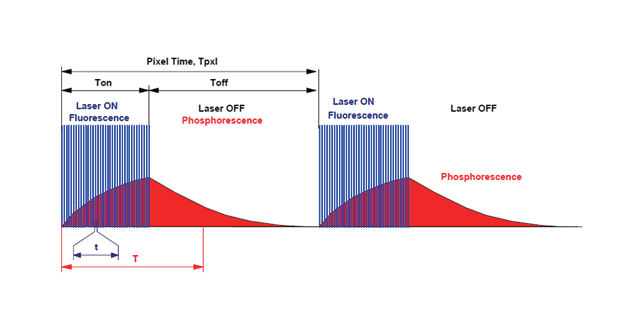
双光子显微镜使用高能量锁模脉冲激光器。国外2PPLUS双光子显微镜授权商
王爱民副教授结合工作实例,展示了双光子显微镜的研发与应用。历经3年多的协同奋战,成功研制新一代高速分辨微型化双光子荧光显微镜,重量只为2.2克,这一微型显微镜获取了小鼠在自由行为过程中大脑神经元和神经突触活动清晰、稳定的图像,该显微镜适于佩戴在小动物头部,可实时记录数十个神经元、上千个神经突触的动态信号,在大型动物上,还可望实现多探头佩戴、多颅窗不同脑区的长时程观测。双光子显微成像的在生物医学研究和医疗领域应用有较大的应用前景,首先双光子显微镜能够进行细胞和组织结构成像,在亚微米级成像,此功能与目前市场上的共聚焦类显微镜性能类似;双光子显微成像能够实时、在体、原位、无创地,根据不同物质组份的光谱特性,区分成像;双光子显微镜能够进行生化指标成像,在无造影剂的前提下,利用自发荧光、二次谐波、荧光获得活细胞生化信息。国外2PPLUS双光子显微镜授权商