双光子显微镜为什么穿透能力强?生物组织在近红外波段存在两个窗口,第1个近红外窗口对应波长在700nm-900nm,第2个近红外窗口对应波长在1000nm-1400nm之间。举例说明就是单晶硅对于可见光几乎是不透明的,但是对于红外波段就像是“水晶”一样通透性很好了。原因有两点:1.生物组织对红外光的吸收弱,对可见光吸收强。类似的,平时用手电筒照射手指,会看到手通透红亮,也是由于生物组织对长波长的红光吸收少。2.生物组织对红外光的散射弱。因为瑞利散射的强度反比于波长λ的四次方。类似的,早晨的太阳非常红,也就是因为长波长的红光穿透力更强。这两点共同导致长波长的红外光比可见光对生物组织的穿透能力强。双光子显微镜的性能得到不断地优化,结合它的特点,大致可以分成深和活两个方面的提升。进口ultima双光子显微镜授权商

随着技术的发展,双光子显微镜的性能得到不断地优化,结合它的特点,大致可以分成深和活两个方面的提升。要想让激发激光进入更深的层面,大致可从两个方面入手,装置优化与标本改造。关于装置优化,我们可以把激光束变得更细,使能量更加集中,就能让激光穿透更深。关于标本,其中影响光传播的主要是物质吸收和散射,解决这个问题,我们需要对样本进行透明化处理。一种方法是运用某种物质将标本浸泡,使其中的物质(主要是脂质)被破坏或溶解。另一种方法是运用电泳将脂质电解,让标本的“透明度”得到提高。国外激光荧光双光子显微镜荧光探测双光子显微镜在生物医学研究中有广泛的应用,可以观察细胞内的亚细胞结构、蛋白质分布、细胞活动等。
在国家自然科学基金委国家重大科研仪器研制专项《超高时空分辨微型化双光子在体显微成像系统》的支持下,北京大学分子医学研究所、信息科学技术学院、动态成像中心、生命科学学院、工学院联合中国人民医学科学院组成跨学科团队,历经三年多的协同奋战,成功研制新一代高速分辨微型化双光子荧光显微镜,并获取了小鼠在自由行为过程中大脑神经元和神经突触活动清晰、稳定的图像。原始论文于5月29日在线发表于自然杂志子刊NatureMethods(IF25.3),并已申请多项。
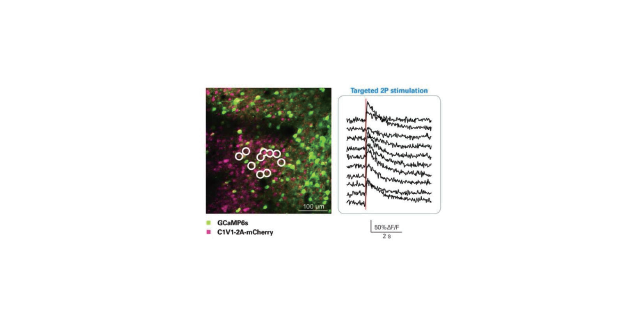
配合双光子激发技术,激光共聚扫描显微镜则能更好得发挥功效。那么,什么是双光子激发技术呢?在高光子密度的情况下,荧光分子可以同时吸收2个长波长的光子使电子跃迁到较高能级,经过一个很短的时间后,电子再跃迁回低能级同时放出一个波长为长波长一半的光子(P=h/λ)。利用这个原理,便诞生了双光子激发技术。双光子显微镜使用长波长脉冲激光,通过物镜汇聚,由于双光子激发需要很高的光子密度,而物镜焦点处的光子密度是比较高的,所以只有在焦点处才能发生双光子激发,产生荧光,该点产生的荧光再穿过物镜,被光探头接收,从而达到逐点扫描的效果。双光子显微镜不需要共聚焦细孔,提高了荧光检测效率。

首先我们来简单介绍一下激光扫描共聚焦和双光子这两种当红的显微成像技术。激光扫描共聚焦显微技术,是荧光显微成像的一种,用于激发样品的荧光信号并对其放大成像。在激光扫描共聚焦显微镜中,样品焦平面上每一时刻只有一个点被激发光照射,纵然焦平面外也有激发光照射,但通过探测器前的(pinhole),有焦平面上的荧光信号能被探测器接收。也就是说,每个时刻,只有焦平面上一个点的信号被探测。通过点扫描的方式,一个个点的信号就可以组合出终的图像。双光子显微镜(包括多光子显微镜)同样采用点扫描的方式得到图像。不同的是,其采用的激发光波长较长,只有当两个(或更多)激发光光子几乎同时轰击荧光探针的时候才可能激发出荧光信号。所以只有在光子密度特别大的焦点,出才会激发出荧光。也就是说,双光子显微镜中,同样每个时刻只有焦平面上一个点的信号被探测,并且连焦平面外的荧光信号也不会有。双光子显微镜在组织透明化成像中应用;进口ultima双光子显微镜授权商
于双光子激发需要两个光子同时到达,因此只有在焦点附近的样品区域才会激发,从而实现三维成像和高分辨率。进口ultima双光子显微镜授权商
后续实验使用碘化丙啶(PI)来指示细胞在7、8、9和10分钟的延时观察后的损伤情况,来验证该光学系统对活细胞长期观察的适用性。在观察期间,88个焦点以100毫秒的曝光时间,曝光间隔1s照射样品,激发强度为3.21×104W/cm2,激发波长为525nm,使用前文提到的60×物镜及1.0AU孔径,图5(a)-(d)为引入PI的成像图,(e)-(h)为相应的相应衬度图。改变激发条件为每照射500ms间隔5s,得到相应的(i)-(p)。由图像可知,延时观察小于8分钟的情况下不造成可见细胞损伤,对于实际3D延时成像,由于焦平面是移动的,所以预期细胞存活时间会更长,可见这是一种在3D在体延时成像中具有很大优势的成像方案。进口ultima双光子显微镜授权商