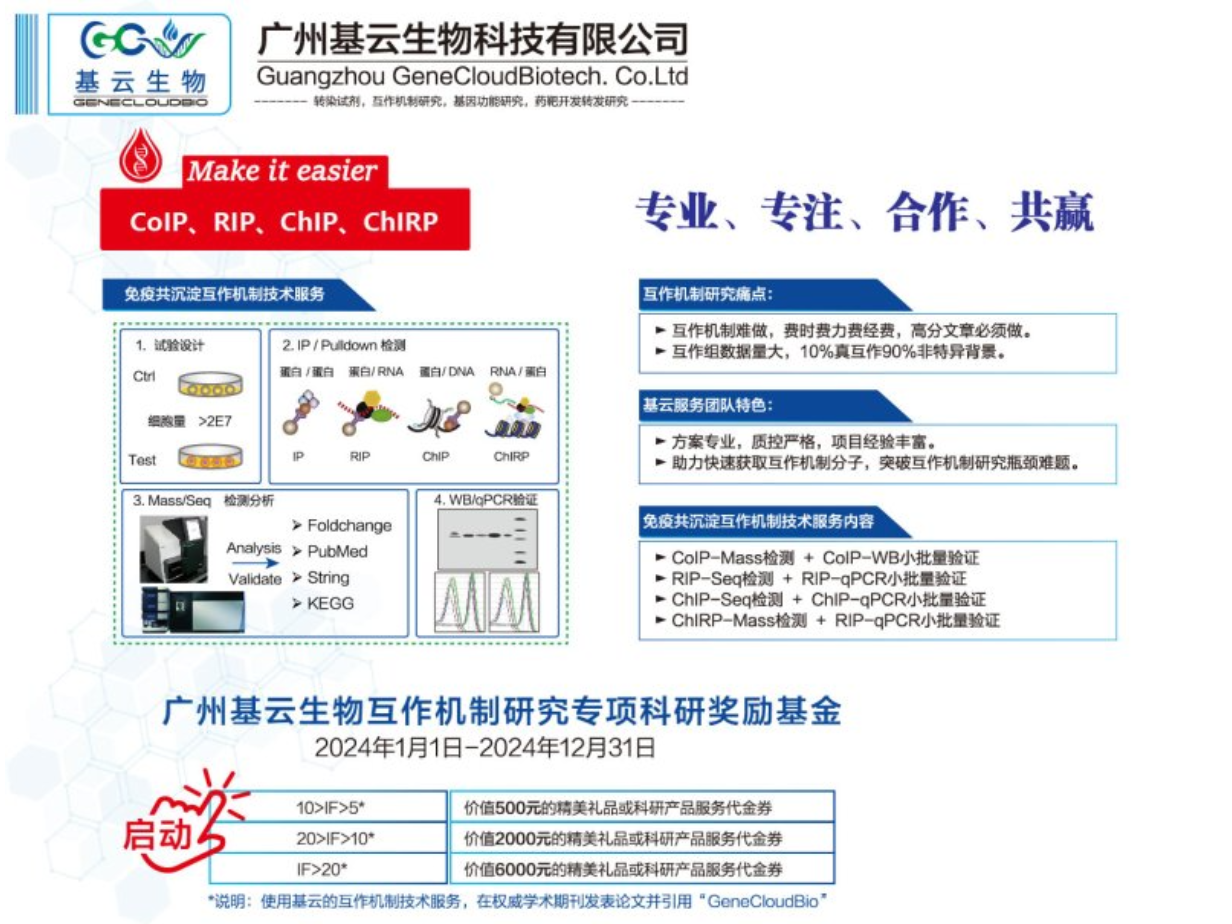
RIP-seq实验的基本实验流程如下:准备样本:收集并处理适当的细胞或组织样本,确保样本的质量和数量满足实验需求。免疫沉淀:利用特定蛋白的抗体,通过免疫沉淀技术将RNA-蛋白质复合物从样本中分离出来。这一步骤能够确保只捕获与目标蛋白结合的RNA分子。破碎与文库制备:将捕获的RNA-蛋白质复合物进行破碎处理,释放出RNA分子,并制备成测序文库。这一步骤涉及RNA的纯化和逆转录等过程,以便进行后续的测序分析。高通量测序:利用高通量测序技术对制备好的RNA测序文库进行测序,获得大量的测序数据。这些数据将用于分析RNA与蛋白质的相互作用。数据分析:对测序数据进行生物信息学分析,包括序列比对、峰值调用和注释等步骤,以识别与特定蛋白结合的RNA序列,并揭示它们在细胞内的功能和调控机制。整个实验流程需要严格控制实验条件,确保实验的特异性和准确性。通过RIP-seq实验,可以详细了解RNA与特定蛋白质的相互作用情况,为深入研究基因表达调控和细胞生物学过程提供有力支持。RIP实验是一种强大的技术,用于研究细胞内RNA与蛋白质的相互作用。山东RNA蛋白互作检测RIP qPCR检测
做好RIP-qPCR实验,应避免以下常见问题。1. RNA降解:RNA极易降解,因此在实验过程中应始终使用无RNase的试剂和耗材,并在冰上操作以维持低温环境。样本处理后应立即进行后续实验,避免长时间存储。2. 非特异性结合:使用特异性强的抗体进行免疫沉淀是关键。同时,设置适当的对照实验,如使用非特异性抗体作为阴性对照,有助于识别非特异性结合。3. 引物问题:引物设计不合理可能导致非特异性扩增或引物二聚体形成。应确保引物具有高特异性,并避免引物间存在互补序列。4. 污染问题:实验过程中应严格避免RNA酶和其他污染物的引入。使用洁净的实验台和消毒的器具,实验人员应穿戴实验服和手套。5. 数据解读错误:在数据分析时,应注意识别并排除异常值。同时,使用适当的统计方法,确保结果的准确性和可靠性。对于不符合预期的结果,应进行重复实验以验证其真实性。通过避免这些常见问题,可以较大程度提高RIP-qPCR实验的成功率和准确性。在实验过程中,始终保持谨慎和细致的态度,遵循实验规范,是获得可靠结果的关键。广东RNA免疫沉淀RIP-qPCR检测RIP-qPCR实验技术有哪些优缺点。
在分子机制研究过程中,RIP-seq(RNA免疫沉淀后测序)实验技术是一种强大的工具,用于详细研究细胞内RNA与蛋白质的相互作用。RIP-seq主要应用于识别和分析与特定RNA结合蛋白(RBP)结合的RNA分子。通过该技术,研究者可以了解RBP在细胞内的靶标RNA,并进一步研究这些RNA在细胞功能、基因表达调控以及疾病发生、发展中的作用。在疾病研究领域,RIP-seq具有广泛的应用。例如,可用于鉴定与疾病相关RBP结合的RNA,从而揭示疾病发生和发展的分子机制。除了疾病研究,RIP-seq还可用于探索细胞内的转录后调控机制。通过分析RBP与RNA的结合模式,可以揭示RNA剪接、修饰、转运和降解等过程中的关键调控因子和机制。此外,RIP-seq还可与其他高通量技术相结合,如转录组测序(RNA-seq)、蛋白质组学等,共同构建细胞内的RNA-蛋白质相互作用网络,为系统生物学研究提供有力支持。总之,RIP-seq实验技术在分子机制研究中具有广泛的应用场景,特别是在疾病相关分子机制、转录后调控机制以及细胞功能研究等方面。随着技术的不断发展,RIP-seq将在分子机制研究领域发挥越来越重要的作用。
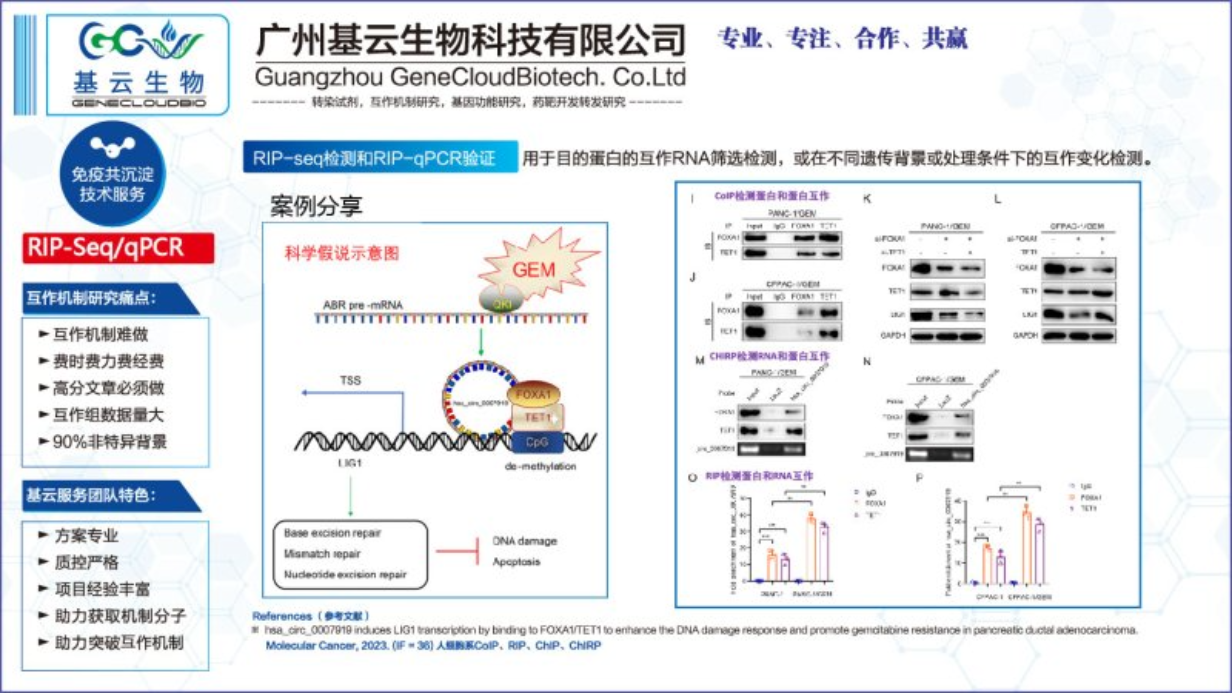
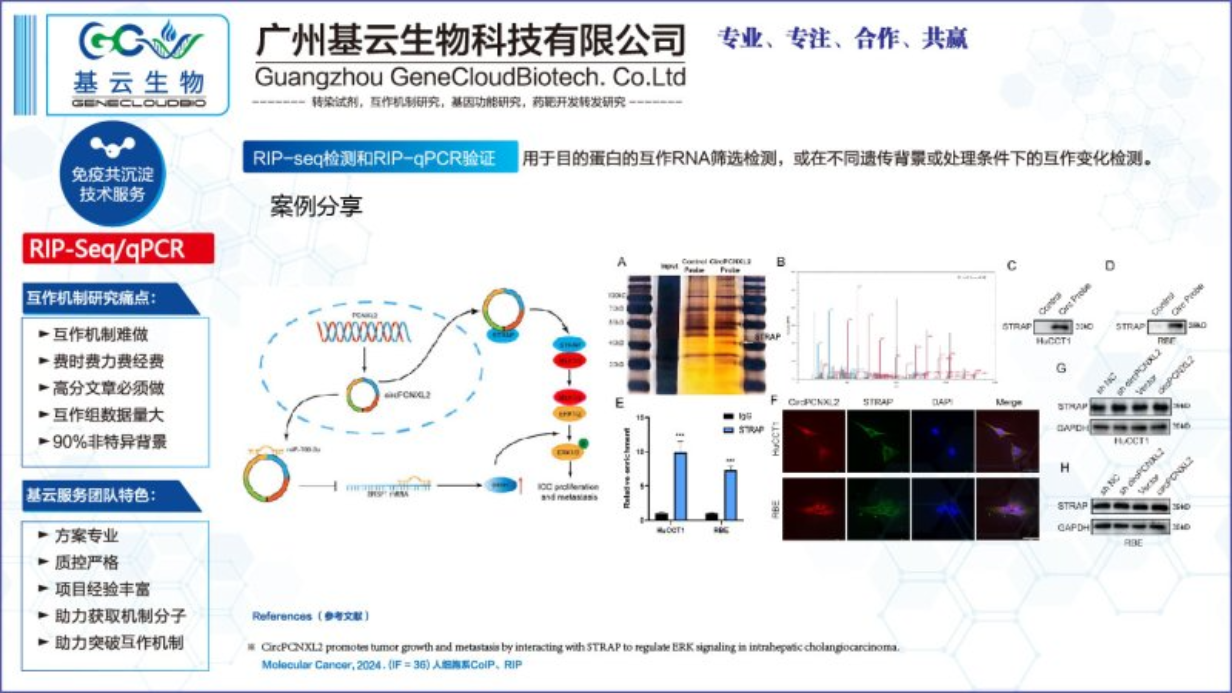
RIP-Seq检测和RIP-qPCR验证要点:
实验设计:尽量进行实验组别设计和生物学重复检测,提高后续验证的阳性率。常规过表达单组(AbIPvsIgGIP);动态互作组学(实验组vs对照组vsIgG组)。根据目的设计适当的生物学重复。如果后续以RIP-Seq数据进行互作组标准分析,则需要3-4组生物学重复;如果后续以寻找关键互作RNA,进行深入的机制研究,则建议1-2次生物学重复。经验显示单次重复假阳性率达90%。RIP-Seq强烈建议设置实验组别和生物学重复检测。
蛋白表达和细胞量:细胞用量要不少于5e7(金标准:320g离心细胞量50μl,保障项目用量)。本底低表达蛋白,建议使用过表达组进行检测。蛋白表达可根据WB结果或初步根据数据库判定。
抗体关键质控:抗体特异性与亲和效价要求高,尽量采用标签抗体或经过CoIP效果验证的抗体。抗体质量参差不齐(WB能检测到预期条带不到1/2,能检测到良好结果的不到1/4)和存在非特异性结合(几乎所有的抗体都存在非特异结合,部分非特异结合条带远大于目的条带),RIP-Seq需做WB和IP-WB质控。抗体可参考数据库。
互作蛋白筛选和验证:数据分析以信号强度作为强阳筛选,以文献查阅,功能匹配,批量RIP-qPCR验证,提高验证成功率。 做好RIP-seq实验,应该注意哪几个问题。
RIP-qPCR实验技术,是一种研究细胞内RNA与蛋白质相互作用的重要方法,具有广泛的应用场景。首先,在转录后调控研究中,RIP-qPCR可用于识别与特定RNA结合蛋白(RBP)相互作用的RNA分子,从而揭示RBP在转录后调控网络中的功能。这有助于深入了解基因表达的调控机制,包括mRNA稳定性、剪接和翻译等过程。其次,RIP-qPCR可用于验证生物信息学预测或高通量筛选结果。例如,在预测了某个RBP的潜在靶标RNA后,可以利用RIP-qPCR实验进行验证,确认它们之间的相互作用关系。此外,RIP-qPCR还可应用于疾病机制研究中。许多疾病的发生与发展与RNA与蛋白质的异常相互作用有关。通过RIP-qPCR技术,可以研究这些异常相互作用在疾病进程中的作用,为疾病的诊疗提供新的思路。另外,在药物研发领域,RIP-qPCR也具有潜在的应用价值。例如,可以研究药物对特定RNA-蛋白质相互作用的影响,从而评估药物的疗效和机制。总之,RIP-qPCR实验技术在转录后调控、生物信息学验证、疾病机制研究和药物研发等多个领域具有广泛的应用前景,为生物医学研究提供了有力的工具。RIP-qPCR实验的引物设计至关重要,直接影响到实验的特异性和灵敏度,如何设计RIP-qPCR实验引物。湖南RIP测序
RIP-qpcr实验,有哪些优点。山东RNA蛋白互作检测RIP qPCR检测
RIP-qPCR实验技术虽然是一种强大的研究RNA与蛋白质相互作用的方法,但也存在一些不足之处。技术难度较高:RIP-qPCR实验涉及多个复杂的步骤,包括细胞裂解、免疫沉淀、RNA提取、逆转录和实时定量PCR等。每一步都需要精确的操作和严格的实验条件控制,技术难度较高,需要经验丰富的实验人员才能准确完成。可能受到非特异性结合的干扰:尽管RIP技术利用特异性抗体来沉淀目标RNA-蛋白质复合物,但在某些情况下,非特异性结合可能会干扰实验结果。这可能导致假阳性或假阴性的结果,影响数据的准确性和可靠性。抗体质量要求高:RIP-qPCR实验的结果在很大程度上取决于所使用的抗体的质量和特异性。如果抗体质量不佳或特异性不强,可能会导致实验失败或结果不准确。因此,在选择抗体时需要充分的验证。RNA易降解:RNA分子在实验过程中很容易受到降解,特别是在不适当的实验条件下,如存在RNase污染、操作时间过长或温度控制不当等。RNA的降解会严重影响RIP-qPCR实验的结果,因此在实验过程中需要采取一系列措施来保护RNA的完整性。综上所述,尽管RIP-qPCR实验技术具有许多优点,但也存在一些不足之处,需要在实验设计和操作过程中予以充分考虑和应对。山东RNA蛋白互作检测RIP qPCR检测