- 品牌
- 弗瑞思
- 服务项目
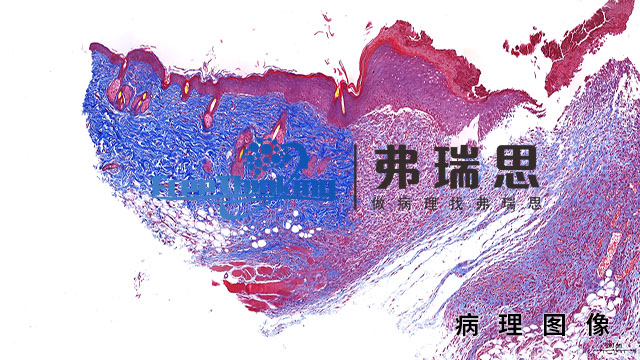
- 免疫组化
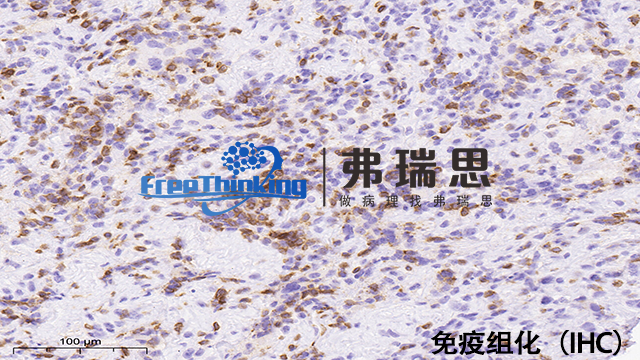
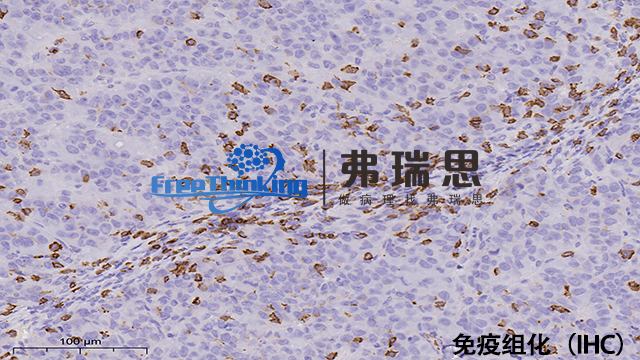
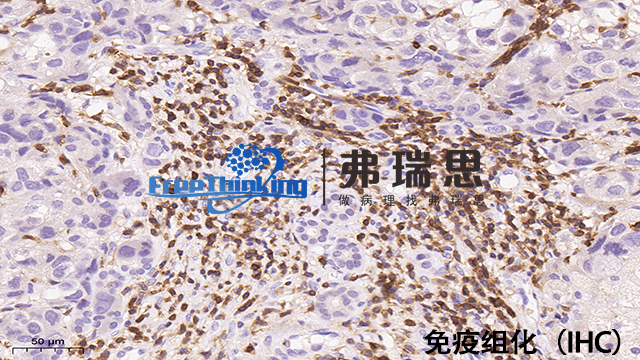
一份免疫组化的报告,里面会有很多的加号(+),和减号(-)。那么这些加号和减号是什么意思呢?加号越多是说我们的疾病严重程度越高吗?不用担心,并不是这样的。免疫组化中的(+),也就是指阳性,指切片中的某些细胞表达特定的免疫标记,而(-)即阴性,指这些细胞不表达这些免疫标记。这些免疫标记的阳性与阴性表示了细胞的来源,也就是说我们是通过这些不同标记的阳性阴性来认识这些细胞,从而给这些细胞贴上"名片”的。所以这些(+)(-)与疾病的严重程度或者恶性程度没有关系。免疫组化在Tumor分类、分期中发挥关键作用。北京病理切片免疫组化实验流程
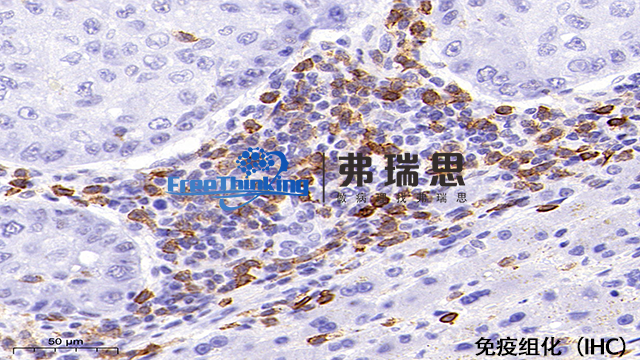
在免疫组化实验中,选择合适的显色方法并优化其条件对于实验结果的准确性和清晰度至关重要。以下是如何选择合适的显色方法并优化其条件的建议:一、选择合适的显色方法。基于实验目的:如果实验需要高灵敏度或多重标记,则荧光法(如FITC、PE等荧光染料)可能是更好的选择。对于常规病理检测,酶法(如DAB显色法)通常选择。考虑样本类型:某些显色方法可能更适合特定类型的样本,如组织切片或细胞培养物。二、优化显色条件。显色剂浓度:根据实验需求和所用显色剂的推荐浓度,调整显色剂的浓度。例如,对于DAB显色法,常用的DAB浓度范围在0.05%-0.5%之间。孵育时间:显色剂的孵育时间也是影响实验结果的关键因素。通过预实验确定孵育时间,通常孵育时间在几分钟到几十分钟不等。冲洗步骤:在显色反应后,应充分冲洗切片以去除未结合的显色剂,减少背景染色。温度控制:确保显色反应在适当的温度下进行,以避免影响显色效果。三、总结。选择合适的显色方法并优化其条件可以明显提高免疫组化实验的准确性和清晰度。在选择显色方法时,应基于实验目的和样本类型进行考虑;在优化条件时,应关注显色剂浓度、孵育时间、冲洗步骤和温度控制等因素江门组织芯片免疫组化扫描如何提高免疫组化染色结果的特异性?
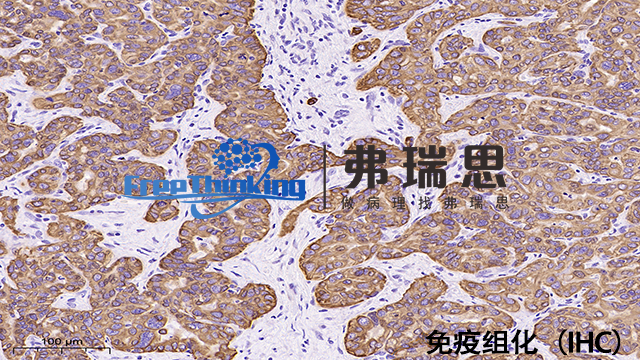
免疫组化实验中的背景染色问题可以通过以下几种方式减少:1、优化抗体选择:选择特异性高、交叉反应少的抗体,这可以有效降低非特异性结合,减少背景染色。2、调整抗体浓度:过高的抗体浓度可能导致非特异性结合增多,因此适当降低抗体浓度可以减少背景染色。3、缩短孵育时间:长时间孵育可能导致抗体与非特异性位点的结合增加,适当缩短孵育时间有助于减少背景染色。4、使用阻断剂:在染色前使用阻断剂,如牛血清白蛋白(BSA)、鱼胶原蛋白(Gelatin)等,可以阻断非特异性结合位点,降低背景染色。5、优化组织处理:对组织进行适当的固定和脱水处理,可以减少组织中的干扰物质,降低背景染色。6、优化实验条件:保持实验条件的一致性,如温度、pH值等,可以减少实验误差,降低背景染色的可能性。7、增加阴性对照:在实验中增加阴性对照,有助于识别并区分非特异性染色,从而降低背景染色的影响。
在免疫组化实验中,切片厚度对实验结果具有明显影响,主要体现在以下几个方面:1、抗原暴露与检测:较薄的切片能够更好地展示组织结构的细节,并有助于抗原的充分暴露。这有利于抗体与抗原的充分结合,从而提高检测的灵敏度和准确性。例如,对于淋巴结、肾等组织,切片厚度通常不超过3μm,以确保抗原的充分暴露。2、观察效果:切片过厚会导致细胞重叠,影响显微镜下的观察效果。细胞重叠会掩盖某些细节,使结果分析变得困难。同时,过厚的切片还可能导致脱片现象,进一步影响实验结果的可靠性。3、试剂渗透性:较薄的切片有利于试剂的渗透,使得抗体、显色剂等试剂能够更快地到达抗原所在位置,提高反应效率。相反,过厚的切片会阻碍试剂的渗透,导致反应不充分或结果不准确。4、实验效率:在相同条件下,较薄的切片更容易被染色和观察,从而提高实验效率。同时,薄切片所需的试剂量也相对较少,有助于降低实验成本。免疫组化实验中的切片厚度对实验结果具有重要影响。根据组织类型和实验需求选择合适的切片厚度至关重要。一般来说,对于需要较高灵敏度和准确性的实验,应选择较薄的切片;而对于需要展示组织结构细节的实验,可适当增加切片厚度。免疫组化实验中,阳性对照的选择标准是什么?
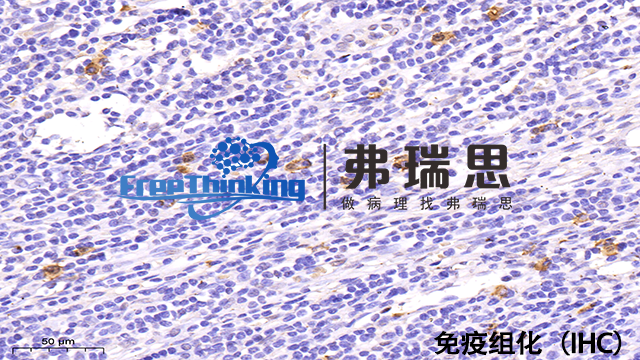
在免疫组化实验中,优化抗体孵育条件对于确保实验结果的准确性和可靠性至关重要。以下是关于如何优化抗体孵育条件的建议:1、温度控制:抗体孵育的温度通常可以在4°C、室温或37°C之间进行选择。4°C过夜孵育通常效果好,但时间较长。室温或37°C孵育可以缩短时间,但可能增加非特异性结合的风险。建议根据抗体说明书和实验需求选择适当的孵育温度。2、孵育时间:孵育时间的长短取决于抗体的浓度、亲和力和目标抗原的表达水平。一般来说,37°C下孵育1-2小时或4°C下过夜孵育是常见的选择。若发现信号较弱,可适当延长孵育时间;若背景染色较严重,则应缩短孵育时间。3、抗体浓度:抗体浓度是影响孵育效果的关键因素之一。通常,建议从抗体说明书推荐的浓度开始,并根据预实验结果进行调整。若信号较弱,可适当提高抗体浓度;若背景染色较严重,则应降低抗体浓度。4、孵育环境:确保孵育环境湿润,避免切片干燥。使用适当的孵育盒或湿盒,确保抗体溶液均匀覆盖组织切片。5、其他因素:注意避免抗体溶液的过度蒸发,可加盖湿纱布或使用其他保湿方法。在孵育过程中避免切片受到机械性损伤或污染。免疫组化结合图像分析软件,可实现细胞定量分析,提高研究客观性。宿迁病理切片免疫组化价格
免疫组化是病理诊断不可或缺的手段。北京病理切片免疫组化实验流程
免疫组化实验在以下情况下需要特别注意实验条件的优化:1、使用新型抗体或试剂时:新型抗体或试剂的引入可能带来不同的特异性、亲和力和稳定性。因此,在使用前需要仔细查阅相关文献,了解其特性,并通过预实验来优化其工作浓度和条件,以确保实验结果的准确性和可靠性。2、样本类型和处理方法变化时:不同的样本类型(如石蜡切片、冰冻切片等)和处理方法(如固定、脱水、包埋等)可能会影响抗原的暴露和保存。因此,当样本类型或处理方法发生变化时,需要调整实验条件,如抗体的浓度、孵育时间等,以适应新的样本特性。3、对实验结果的灵敏度和特异性要求较高时:在某些情况下,如疾病诊断、药物研发等,对免疫组化实验的灵敏度和特异性要求非常高。此时,需要仔细优化实验条件,如使用特异性更高的抗体、优化抗原修复条件、选择更合适的显色剂等,以提高实验的灵敏度和特异性。4、出现非特异性染色或背景噪音较高时:非特异性染色和背景噪音是免疫组化实验中常见的问题。当这些问题出现时,需要仔细检查实验流程,找出问题所在,并针对性地优化实验条件,如增加洗涤步骤、调整抗体浓度等,以降低非特异性染色和背景噪音。北京病理切片免疫组化实验流程
免疫组化染色在实际中有广泛应用。在病理诊断方面,可用于确定细胞来源和分化程度,帮助区分不同类型的疾病。例如,通过特定抗体染色判断细胞的类型和性质。在研究领域,可研究特定蛋白在组织中的表达分布,揭示疾病发生的发展机制。同时,还可用于评估疾病的预后,某些蛋白的表达水平与疾病的进展和预后相关。此外,免疫组化染色还可用于检测病原体,如病毒、细菌等在组织中的存在情况。通过对组织样本进行免疫组化染色,可以为临床诊断、诊疗决策和科学研究提供重要的依据。免疫组化的原理是什么?韶关病理切片免疫组化在荧光共定位研究的免疫组化实验中,选择荧光标记抗体有以下关键策略:一是合理选择荧光染料。要考虑不同荧光染料的激发和发...
- 茂名多重免疫组化原理 2024-11-15
- 徐州组织芯片免疫组化原理 2024-11-15
- 揭阳多重免疫组化扫描 2024-11-10
- 连云港免疫组化 2024-11-09
- 中山病理切片免疫组化实验流程 2024-11-09
- 连云港组织芯片免疫组化原理 2024-11-07
- 湛江组织芯片免疫组化 2024-11-04
- 湖州病理切片免疫组化分析 2024-11-04
- 台州多重免疫组化 2024-11-03
- 河源组织芯片免疫组化扫描 2024-11-03
- 台州免疫组化扫描 2024-10-28
- 金华病理切片免疫组化原理 2024-10-28
- 杭州病理切片免疫组化实验流程 2024-10-27
- 泰州组织芯片免疫组化原理 2024-10-14
- 佛山免疫组化 2024-10-14
- 衢州组织芯片免疫组化实验流程 2024-10-14


- 中山油红O病理图像价格 12-26
- 金华组织芯片病理图像扫描 12-25
- 北京多色免疫荧光病理图像价格 12-25
- 嘉兴病理图像价格 12-21
- 茂名HE染色病理图像 12-21
- 清远多色免疫荧光病理图像扫描 12-19
- 南京油红O病理图像实验流程 12-18
- 淮安多色免疫荧光实验流程 12-17
- 佛山TME多色免疫荧光价格 12-17
- 北京TME多色免疫荧光TAS技术原理 12-13