ChIP-seq实验是研究蛋白质与DNA相互作用的重要手段,具有必要性和重要性。首先,ChIP-seq能够详细地揭示转录因子等蛋白质在基因组上的结合位点,这对于理解基因表达调控机制至关重要。通过绘制全基因组范围内的蛋白质结合图谱,我们可以更深入地了解转录因子如何调控靶基因的表达,进而解析复杂的生物过程。其次,ChIP-seq实验具有高通量和高分辨率的特点,能够同时检测多个样本中的蛋白质结合情况,并提供精确的结合位点信息。这使得我们可以在不同生理条件下比较蛋白质结合模式的差异,揭示转录调控的动态变化。此外,ChIP-seq数据还可以与其他组学数据进行整合分析,如转录组学、表观遗传学等,从而更好地解析基因调控网络。这种多组学联合分析的方法有助于我们发现新的调控因子和调控机制,推动生物学研究的深入发展。综上所述,ChIP-seq实验对于解析基因表达调控机制、揭示转录因子在生物过程中的作用以及推动多组学联合分析具有重要意义。因此,开展ChIP-seq实验是十分必要的。作为新手,开展ChIP实验应该注意什么。chromatin蛋白相互作用ChIP测序

ChIP-qPCR和ChIP-seq实验在多个方面存在异同点。首先,在实验流程上,两者都包含染色质免疫沉淀这一关键步骤,用于富集与特定蛋白质结合的DNA片段。然而,在后续的检测方法上,它们有所不同。ChIP-qPCR采用实时荧光定量PCR技术对这些片段进行定量检测,适用于已知蛋白质与靶序列相互作用的研究。而ChIP-seq则结合了高通量测序技术,能够在全基因组范围内检测与特定蛋白质结合的DNA区域,适用于未知靶序列的探索。其次,在分辨率上,ChIP-seq具有更高的分辨率,能够提供完整、高分辨率的结合信息,绘制出转录因子等蛋白质在全基因组范围内的结合位点图谱。而ChIP-qPCR的分辨率相对较低,通常只能针对已知基因或基因区域进行分析。另外,在应用范围上,ChIP-seq在探索转录调控网络、表观遗传机制等领域具有更广泛的应用价值。而ChIP-qPCR则更适用于验证特定转录因子与基因启动子的结合等具体作用机制的研究。综上所述,ChIP-qPCR和ChIP-seq在实验流程、分辨率和应用范围上存在异同点,研究者应根据具体需求选择合适的技术方法。天津染色体免疫共沉淀检测ChIPChIP实验优点和缺点是什么。
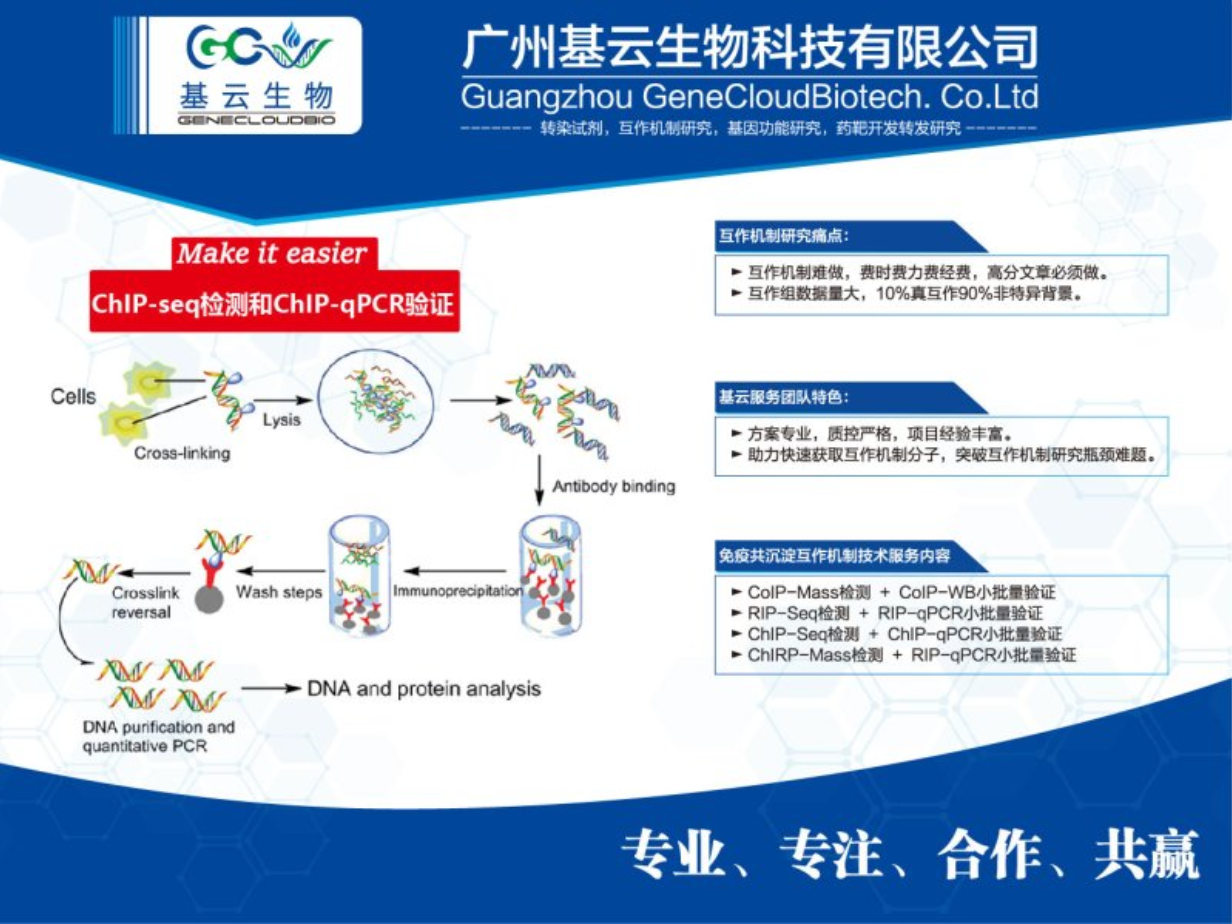
ChIP-seq实验具有多个优点。首先,其高灵敏度能够检测到转录因子在基因组中的低水平表达,并有效地识别其结合位点。这意味着即使转录因子的表达量很低,ChIP-seq也能准确地找到它们的作用位置。其次,ChIP-seq实验具有高特异性,通过使用特定抗体识别目标转录因子,确保了实验结果的准确性。这种特异性使得研究者能够更精确地了解转录因子在基因调控中的作用。此外,ChIP-seq实验提供了全局视角,能够揭示转录因子在整个基因组中的结合模式。这有助于研究转录因子在不同生理条件下的功能,以及它们如何与其他调控因子相互作用来影响基因表达。值得一提的是,ChIP-seq实验不仅适用于真核生物,还可以应用于原核生物。这扩大了其应用范围,使得更多种类的生物可以利用这项技术进行研究。ChIP-seq实验产生的数据具有高分辨率,能够提供精确的蛋白质结合位点列表,增强了研究结果的可靠性和精确性。这种高分辨率的数据为深入研究转录调控机制提供了有力支持。
ChIP实验,即染色质免疫沉淀,是研究细胞内蛋白质与DNA相互作用的关键技术。它利用特异性抗体将目标蛋白与其结合的DNA片段共同沉淀下来,进而分析这些DNA片段,揭示蛋白在基因组上的结合位点。ChIP实验在转录调控、表观遗传学等领域有广泛应用,对于解析基因表达调控网络至关重要。实验流程包括细胞交联、裂解、染色质片段化、免疫沉淀、解交联和DNA纯化等步骤。每个步骤都需精细操作以确保结果可靠性。数据分析时,常结合高通量测序技术,以获取全基因组范围内的蛋白结合信息。ChIP实验是探索生命奥秘的有力工具,但技术难度较高,需严格操作和精确分析。随着技术发展,ChIP实验将更趋完善,为生命科学研究提供更深入、更全的视角。染色质免疫沉淀(Chromatin Immunoprecipitation,ChIP)是研究体内蛋白质与DNA相互作用的一种技术。

ChIP-qPCR实验虽然是一种有效的研究蛋白质与DNA相互作用的方法,但也存在一些缺点。首先,ChIP-qPCR实验通常只能针对已知基因或基因区域进行分析,无法在全基因组范围内寻找未知的结合位点,这在一定程度上限制了其应用范围。其次,该实验方法的分辨率相对较低,可能无法精确到具体的结合位点,只能确定大致的结合区域。这可能会影响对转录因子等蛋白质在基因调控中具体作用机制的深入理解。此外,ChIP-qPCR实验的结果可能受到多种因素的影响,如抗体的特异性、交联条件、染色质片段化效果等。这些因素可能导致实验结果的稳定性和可重复性受到一定程度的影响。另外,ChIP-qPCR实验需要相对较多的起始材料,且实验步骤较为繁琐,需要经验丰富的实验人员进行操作。这可能会增加实验的难度和成本,限制其在一些实验室的广泛应用。综上所述,尽管ChIP-qPCR实验在研究蛋白质与DNA相互作用方面具有一定的应用价值,但也存在一些缺点需要在实际应用中予以注意和克服。ChIP-seq与ChIP-qPCR都应用于研究蛋白质在基因组上的结合情况。陕西chromosome免疫共沉淀ChIP
ChIP-seq与ChIP-qPCR在实验原理和应用方面存在一些相同点。chromatin蛋白相互作用ChIP测序
ChIP-seq与ChIP-qPCR在实验技术、分辨率和数据分析方面存在明显的不同之处。首先,ChIP-seq结合了高通量测序技术,能够在全基因组范围内检测蛋白质与DNA的结合位点。它通过测序仪对富集的DNA片段进行大规模并行测序,生成海量的数据,从而提供高分辨率的结合位点信息。相比之下,ChIP-qPCR则侧重于对特定基因或基因区域进行定量分析,它通过荧光定量PCR技术检测富集的DNA片段的数量,具有更高的灵敏度和特异性,但只能针对已知序列进行分析。其次,ChIP-seq在分辨率上优于ChIP-qPCR。由于ChIP-seq可以对全基因组进行测序,它能够检测到更多的结合位点,包括那些低丰度或远离转录起始位点的结合事件。而ChIP-qPCR则受限于所选择的基因或基因区域,可能无法全局反映蛋白质在基因组上的结合情况。在数据分析方面,ChIP-seq生成的数据需要进行复杂的生物信息学分析,包括序列比对、峰值调用、注释和富集分析等步骤。而ChIP-qPCR的数据分析相对简单,主要通过比较不同样品间的荧光信号强度来判断蛋白质的结合情况。chromatin蛋白相互作用ChIP测序